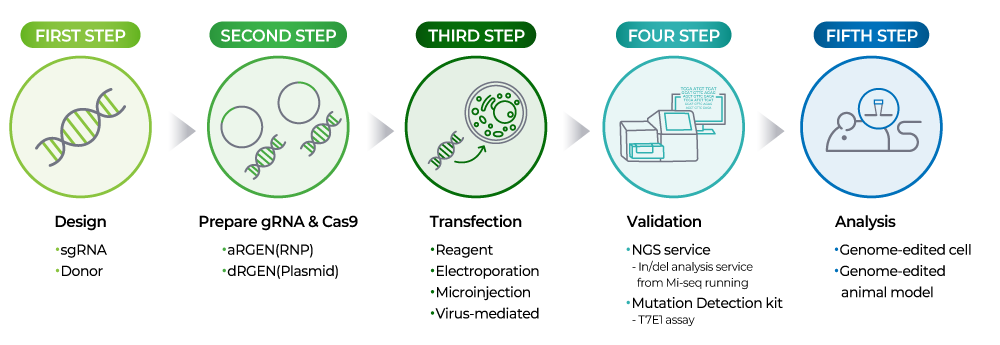
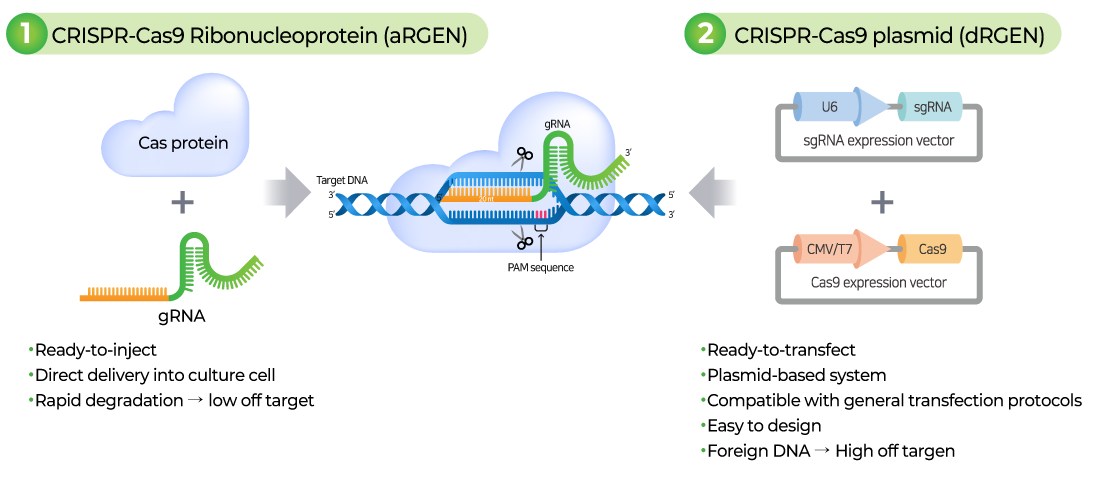
CRISPR Cas9기술은 살아있는 유기체의 DNA를 정밀하게 수정할 수 있게 해주는 혁신적인 유전자 편집 기술입니다. Target DNA를 정확하게 인식하고 결합하는 guide RNA와 target DNA를 절단하는 Cas9 nuclease로 구성되어 DNA 이중 가닥을 손상시키고 이것을 복구하는 과정을 통해 유전자를 조작할 수 있습니다.
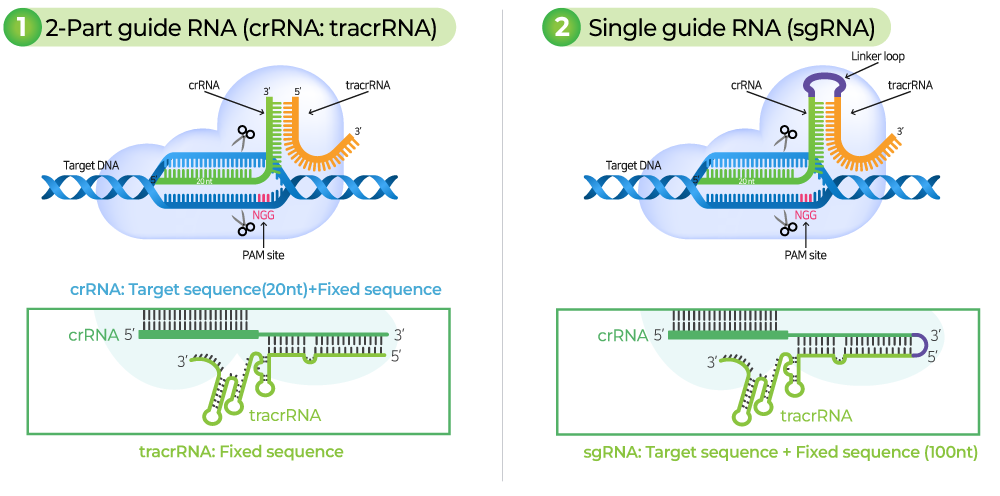
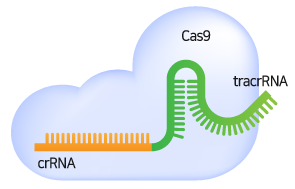
gRNA는 target 서열에 상보적으로 결합하는 crRNA와 Cas9-binding을 위한 tracrRNA로 구성됩니다. gRNA는 Cas9을 target 부분으로 안내하는 역할을 하며, target DNA 서열과 상보적으로 결합합니다. Target DNA 서열 3’ 말단에는 PAM (Protospacer adjacent motif) 서열이 있어야 합니다.
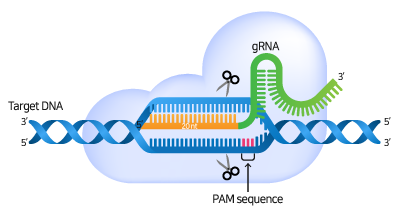
gRNA가 Cas9 nuclease와 복합체를 형성하고 target 서열에 특이적으로 결합하면, Cas9 nuclease는 PAM 서열을 인식하고 PAM의 3 bp upstream 부분에 이중 가닥 손상(Double Strand Break, DSB)을 일으킵니다.
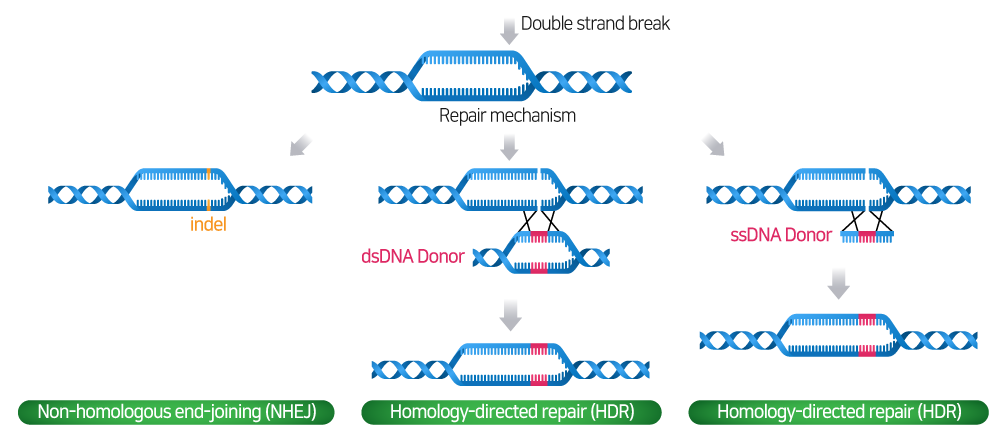
DSB로 인해 손상된 DNA를 복구하기 위하여 세포는 일반적으로 두 가지의 경로를 거치게 됩니다: Non-homologous end-joining (NHEJ) 또는 Homology-directed repair (HDR) pathway.
- NHEJ pathway: Donor template이 없는 경우 NHEJ pathway를 통해 DSB가 재조립되며, 유전자 coding region 내에 Indel (Insertion and deletion) 생성으로 인한 frameshifts 및 premature stop codon으로 유전자 Knock-Out이 만들어집니다.
- HDR pathway: HDR pathway는 Donor template에 의해 정밀하고 정확한 수정 및 새로운 유전자를 삽입할 수 있습니다.